树突状细胞 (DCs),特别是传统的I型树突状细胞 (cDC1),能够呈递肿瘤抗原以及分泌调节T细胞存活和效应功能的细胞因子【1, 2】。在抗肿瘤免疫应答过程中,肿瘤内的cDC1招募T细胞进入肿瘤【3】,重新刺激和扩增肿瘤特异性CD8+ T细胞,并通过促进T细胞的干性来支持T细胞效应功能【4】。而肿瘤细胞(包括肿瘤干细胞)通常通过分泌免疫抑制因子和产生免疫抑制肿瘤微环境来逃避免疫系统,以阻止肿瘤部位DCs的募集和激活【5-7】。团队前期发现在肿瘤细胞(尤其是肿瘤干细胞)中Arf1的缺失激活了T细胞介导的免疫反应,在多种小鼠和PDX肿瘤模型中产生了强大的抗肿瘤作用【8】。然而,肿瘤细胞、DC和T细胞在Arf1缺失的肿瘤微环境中激活抗肿瘤免疫的关系仍然未知。
2023年10月2日,侯宪玉教授研究团队在Advanced Science杂志上发表题为Arf1 Ablation in Colorectal Cancer Cells Activates a Super Signal Complex in DC to Enhance Anti-Tumor Immunity的研究论文。本项研究揭示了Arf1缺失的肿瘤细胞释放的免疫原性因子能够诱导并激活DC细胞中的超级信号传导复合物,进一步通过释放细胞因子和趋化因子共同调节DC的抗原呈递以及促进T细胞肿瘤浸润、交叉启动和干性。
作者首先通过共培养实验确认了Arf1缺失的肿瘤细胞释放了相关因子同时激活了DCs中NLRP3炎症小体信号通路,cGAS-STING信号通路与NF-κB信号通路,并促进IFNβ的分泌。进一步,作者发现在DCs中使用CRISPR-Cas9技术敲除cGAS和STING可显著抑制DCs的活化与炎症因子Ifnα,Ifnβ和Cxcl10的表达。
随后作者在Arf1缺失的CT26细胞的上清中检测到了更多的HMGB1-gDNA复合体。为验证HMGB1对于DCs活化的调控作用,作者在Arf1敲除的CT26中利用抗体中和HMGB1的活性,结果发现DC2.4细胞中cGAS-STING信号通路的活化、NLRP3炎症小体的激活与NF-κB信号通路的活化均被显著抑制。此外,作者发现Arf1缺失的肿瘤细胞上清液中含有更高丰度的氧化低密度脂蛋白(OxLDL)。进一步使用外源性OxLDL处理DC2.4细胞并发现OxLDL可诱导DC2.4细胞中炎症小体的激活并上调活性的IL-1β,以及ASC斑点增加,这些结果表明OxLDL可直接激活DCs中的炎症小体。同时,外源性 OxLDL 与 DCs 中活化的 Caspase-1 共定位,表明 OxLDL 可能直接与 Caspase-1 结合并诱导 DCs 中炎症体的组装和激活。
紧接着作者鉴定了可能介导Arf1缺失引发从肿瘤细胞到DC的信号传递的受体。对DCs中不同受体检测中,作者发现 Arf1缺失引发活化的DCs中Cd36、Tlr2和Tlr6表达量显著上调。通过免疫荧光和免疫共沉淀实验检测到CD36在Arf1缺失导致激活的DCs中与TLR2和TLR6共定位,形成了一个核心受体复合物。而在利用CRISPR-Cas9技术敲除了DCs中的Cd36、Tlr2或Tlr6,或在共培养系统中用药物抑制了核心受体的功能之后,Arf1缺失对DCs的激活现象显著减弱。
随后作者观察到配体-核心受体复合物通过直接结合Arf1抑制刺激的DC中的Rab7被招募到吞噬体中。同时,肿瘤来源的DNA和外源性OxLDL的配体也在DCs中与Rab7共定位。此外,过度表达的cGAS和细胞膜传感器NLRP3分别与肿瘤来源的DNA和外源性OxLDL在DCs中聚在一起。这些结果共同表明了这样一个模型,即配体-核心受体复合物被内化到DC中,然后被招募到吞噬体中,其中自由配体分别被不同的细胞膜传感器识别,形成一个超级信号复合物,激活NF-κB、cGAS-STING和NLRP3炎症体三重途径,在DC中产生CCL5、I型IFN、CXCL10和IL-1家族细胞因子。
随后通过与对照或Arf1缺失的肿瘤细胞预共培养DC, 然后用幼稚CD8 OT1 T细胞重新培养处理过的DC,作者发现与后一组别DC共培养的CD8 OT1 T细胞中的SIINFEKLMHC-I四聚体的频率显着增加并产生更多的IFNγ。而对于超级信号复合物或cGAS-STING信号通路的抑制消除了DC的这种增强效果。这些结果共同表明,Arf1消融刺激的DC具有增强的交叉启动和激活幼稚CD8+ T细胞的能力。
最后作者体内验证了在携带Arf1缺失的肿瘤细胞的小鼠中,利用抗体中和I型IFNs和IL - 1β细胞因子会抑制因Arf1缺失引起的肿瘤消退、干细胞样CD8+ T细胞数量增加以及CD8+ T细胞肿瘤杀伤能力的增强。
综上所述,Arf1缺失的肿瘤细胞释放OxLDL,HMGB1和基因组DNA,它们共同与DC表面上CD36/TLR2/TLR6的共受体复合物结合。此复合物然后由Rab7介导转移进内体,并进一步招募NF-κB,NLRP3炎症小体和cGAS-STING三个通路的组分而形成一个超级信号复合体,激活三通路并产生CCL5,IL-1β,1型IFN和CXCL10。这些细胞因子共同促进DC 活化、增强CD8+ T细胞肿瘤浸润、交叉启动和干性。
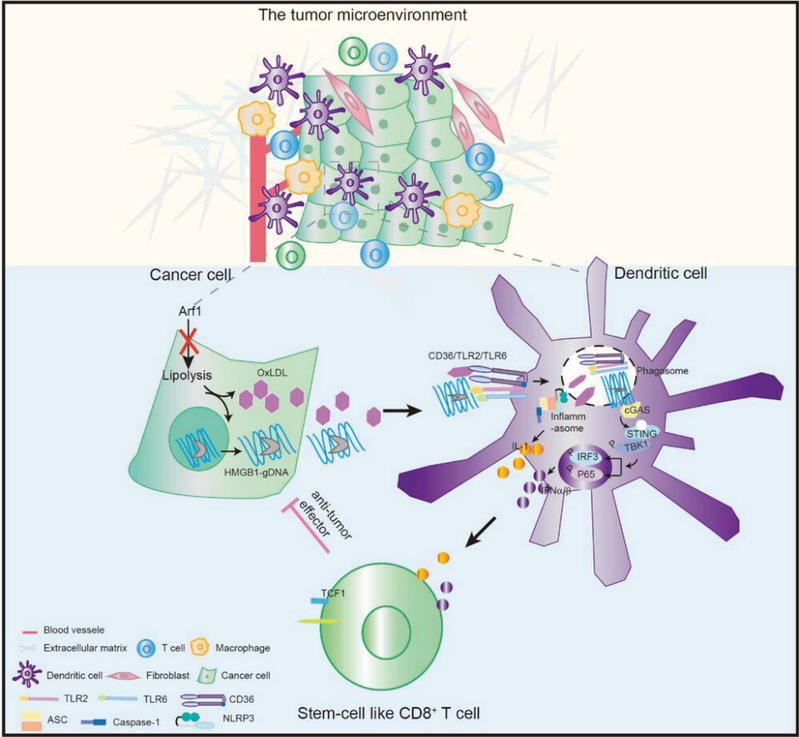
图1 Arf1缺失的肿瘤细胞诱导抗肿瘤免疫的分子机制作用模式图
